FDA记录显示没有目前的这种药物回忆说。beplay sport中心钱包
你是医学专业吗?
Tikosyn回忆
得到一个警告当一个回忆。
问题&答案
副作用和不良反应
TIKOSYN (dofetilide)会导致严重的室性心律失常,主要带条de同构(TdP)类型室性心动过速,多态室性心动过速与QT间隔延长。QT间隔延长dofetilide等离子体浓度直接相关。降低肌酐清除率等因素或某些dofetilide药物相互作用将增加dofetilide血浆浓度。计划书的风险可以减少通过控制等离子体浓度通过调整初始dofetilide剂量根据肌酐清除率和通过监测心电图QT间隔的过度增加。
治疗dofetilide必须开始只在病人放置至少三天的设施,可以提供心电图监测和人员培训管理的存在严重的室性心律失常。计算所有患者的肌酐清除率必须先于dofetilide第一剂量的管理。关于剂量选择的详细说明,请参阅剂量和管理。
dofetilide诱导室性心律失常的风险评估在临床研究的三种方法:1)描述的QT间隔及其关系dofetilide的剂量和血浆浓度;2)通过观察TdP TIKOSYN-treated病人的频率根据剂量;3)通过观察整个心房纤颤患者的死亡率和结构性心脏病患者。
QT间隔增加线性增加TIKOSYN剂量(见图1和图2临床药理学剂量反应和反应浓度增加QT间隔)。
室上性心律失常的人口(房颤患者和其他室上性心律失常),带条de同构的总体发病率为0.8%。计划书的剂量的频率如表4所示。没有病例TdP安慰剂。
| TIKOSYN剂量 | |||||
|---|---|---|---|---|---|
| < 250 mcg的报价 | 250 mcg的报价 | > 250 - 500微克 | > 500 mcg的报价 | 所有剂量 | |
| 的患者数量 | 217年 | 388年 | 703年 | 38 | 1346年 |
| 带条de同构 | 0 | 1 (0.3%) | 6 (0.9%) | 4 (10.5%) | 11 (0.8%) |
如表5所示,TdP减少的速度当病人服用根据他们的肾功能在特殊人群临床药理学,药物动力学,肾功能损害和剂量和管理)。
| 总 | 之前 | 后 | |
|---|---|---|---|
| 人口: | n / n % | n / n % | n / n % |
| 室上性心律失常 | 11/1346 (0.8%) | 6/193 (3.1%) | 5/1153 (0.4%) |
| 钻石瑞士法郎 | 25/762 (3.3%) | 7/148 (4.7%) | 18/614 (2.9%) |
| 钻石MI | 7/749 (0.9%) | 3/101 (3.0%) | 4/648 (0.6%) |
| 钻石房颤 | 4/249 (1.6%) | 0/43 (0%) | 4/206 (1.9%) |
大多数的TdP发生的前三天内TIKOSYN疗法(10/11事件研究中患者室上性心律失常;19/25和4/7事件,在钻石和钻石MI瑞士法郎分别;2/4事件钻石AF分组人口)。
在汇集生存分析室上性心律失常病人的人口(低结构性心脏病的患病率),死亡发生在0.9%(12/1346)的患者接受TIKOSYN和安慰剂组0.4% (3/677)。调整治疗的持续时间,主要诊断、年龄、性别、和结构性心脏病的患病率,点估计的风险比集中研究(TIKOSYN /安慰剂)为1.1 (95% CI: 0.3, 4.3)。钻石瑞士法郎和MI试验研究了结构性心脏病患者的死亡率(射血分数≤35%)。在这些大型双盲研究中,死亡发生在TIKOSYN患者的36%(541/1511)和37%(560/1517)的安慰剂的病人。506年分析钻石心房纤颤患者/颤振基线,TIKOSYN一年死亡率是31%比32%安慰剂(见临床研究)。
由于小数量的事件,不能排除由于TIKOSYN超额死亡率与信心汇集室上性心律失常患者的生存分析的安慰剂对照试验。然而,它是让人放心的,在两个大型安慰剂对照患者死亡率的研究重要的心脏病(钻石瑞士法郎/ MI),没有TIKOSYN-treated患者死亡人数超过患者给予安慰剂(见临床研究)。
(见禁忌症)
因为之间存在线性关系,dofetilide血浆浓度和高职院校学前教育伴随药物干扰新陈代谢或肾消除dofetilide可能增加心律失常的风险(带条de同构)。TIKOSYN CYP3A4代谢在小程度上的同工酶的细胞色素P450系统,这个系统的抑制剂可能会增加系统性dofetilide曝光。更重要的是,dofetilide由阳离子肾脏分泌,消除这个过程的和三个抑制剂已被证明增加系统性dofetilide曝光。对肾的大小影响消除西咪替丁,甲氧苄氨嘧啶和酮康唑(所有禁忌伴随使用dofetilide)表明,所有肾阳离子运输抑制剂应禁忌。
可能发生低钾血症、低镁症与管理potassium-depleting利尿剂,增加潜在的带条de同构。钾的水平应该在正常范围内政府之前TIKOSYN TIKOSYN在正常范围和维护管理(见剂量和管理)。
与其他药物一起使用TIKOSYN延长QT间隔没有被研究过,不推荐。这些药物包括吩噻嗪类、cisapride bepridil,三环类抗抑郁药,某些口服大环内酯类,和某些氟喹诺酮类原料药。类我或第三类抗心律失常的药物前应至少保留三个半衰期与TIKOSYN剂量。在临床试验中,TIKOSYN管理病人之前用口服胺碘酮治疗只有血清胺碘酮含量低于0.3 mg / L或胺碘酮撤回了至少三个月。
法律问题
目前还没有法律信息用于这种药物。
FDA安全警报
目前没有FDA安全警告这种药物。
制造商警告
目前还没有这种药物制造商警告信息。
FDA标记变化
目前没有FDA标签更改用于这种药物。
使用
TIKOSYN表示对于维护正常窦性心律(延迟时间复发心房颤动/心房扑动(AF / AFl))患者心房颤动/心房扑动的大于一周时间转换为正常窦性心律。因为TIKOSYN可能导致威胁生命的室性心律失常,应该留给心房颤动/心房扑动的病人症状。
一般来说,抗心律失常的治疗心房颤动/心房扑动的目标是延长时间在正常窦性心律。复发预计在一些病人临床研究)。
TIKOSYN表示转换的心房颤动、心房扑动正常窦性心律。
TIKOSYN没有被证明是有效的阵发性房颤患者。
历史
目前还没有药物可用于这种药历史。
其他信息
TIKOSYN®(dofetilide)是一种抗心律失常的药物与第三类(心脏动作电位持续时间延长)属性。其经验公式是C19H27N3O5年代2它有一个分子量为441.6。的结构公式是
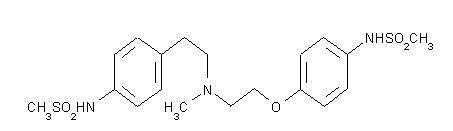
dofetilide的化学名称是:
N-[4 -(2 -(甲基(2 - [4 - ((methylsulfonyl)氨基)苯氧基)乙基]氨基)乙基]苯基]-methanesulfonamide。
Dofetilide是白色的白色粉末。很微溶于水和propan-2-ol溶于0.1水氢氧化钠、丙酮和水0.1盐酸。
TIKOSYN胶囊包含以下活性成份:微晶纤维素,玉米淀粉,胶体二氧化硅,硬脂酸镁。TIKOSYN提供在三个剂型为口服:125微克(0.125毫克)橙色和白色胶囊,250微克(0.25毫克)桃胶囊,和500微克(0.5毫克)桃子和白胶囊。
来源
Tikosyn制造商
-
辉瑞实验室Div辉瑞制药(pfe . n:行情)

Tikosyn |辉瑞实验室Div辉瑞制药(pfe . n:行情)
![Tikosyn (Dofetilide) Capsule [Pfizer Laboratories Div Pfizer Inc] Tikosyn (Dofetilide)胶囊(辉瑞实验室Div辉瑞公司)](//www.lbxkm.com/wp-content/themes/bootstrap/assets/img/loading2.gif)
治疗TIKOSYN必须启动(如果有必要,重新启动)的设置提供了连续的心电图(ECG)监测和人员培训管理存在的严重的室性心律失常。患者应继续以这种方式被监视至少三天。此外,患者不应在12小时内出院电气或药理转换正常窦性心律。的剂量TIKOSYN必须个性化。根据计算肌酐清除率和高职院校学前教育专业(应该使用QT间隔如果每分钟心率< 60次。没有数据时使用TIKOSYN每分钟心率< 50次)。常规推荐剂量的TIKOSYN 500微克的报价,如下修改剂量算法描述。低剂量的考虑,请参阅下面的特殊考虑。血清钾应该保持在正常范围内发起TIKOSYN治疗前,应保持在正常范围内,病人仍在TIKOSYN疗法。(参见警告,低钾血症和Potassium-Depleting利尿剂)。 In clinical trials, potassium levels were generally maintained above 3.6–4.0 mEq/L. Patients with atrial fibrillation should be anticoagulated according to usual medical practice prior to electrical or pharmacological cardioversion. Anticoagulant therapy may be continued after cardioversion according to usual medical practice for the treatment of people with AF. Hypokalemia should be corrected before initiation of TIKOSYN therapy (see WARNINGS, Ventricular Arrhythmia). Patients to be discharged on TIKOSYN therapy from an inpatient setting as described above must have an adequate supply of TIKOSYN, at the patient's individualized dose, to allow uninterrupted dosing until the patient receives the first outpatient supply. TIKOSYN is distributed only to those hospitals and other appropriate institutions confirmed to have received applicable dosing and treatment initiation education programs. Inpatient and subsequent outpatient discharge and refill prescriptions are filled only upon confirmation that the prescribing physician has received applicable dosing and treatment initiation education programs. For this purpose, a list for use by pharmacists is maintained containing hospitals and physicians who have received one of the education programs. Instructions for Individualized Dose Initiation Initiation of TIKOSYN Therapy步骤1。心电图描记的评价:第一剂量管理之前,必须确定使用的高职院校学前教育专业平均5 - 10次。如果大于440毫秒的高职院校学前教育专业(500毫秒)患者心室传导异常,TIKOSYN是禁忌。如果心率小于每分钟60次,应该使用QT间隔。患者心率<每分钟50次没有被研究过。
步骤2。计算肌酐清除率:前政府的第一剂量,患者的肌酐清除率必须使用以下公式计算:
肌酐清除率(男性)=(140 -年龄)×实际体重公斤
72×血清肌酐(mg / dL)肌酐清除率(女)=(140 -年龄)××0.85实际体重公斤
72×血清肌酐(mg / dL)当血清肌酐µmol / L,给出的值除以88.4 (1 mg / dL = 88.4µmol / L)。
步骤3。起始剂量:起始剂量的TIKOSYN决定如下:
计算肌酐清除率TIKOSYN剂量> 60毫升/分钟500 mcg每天两次40 - 60毫升/分钟250 mcg每天两次20 - < 40毫升/分钟125 mcg每天两次< 20毫升/分钟Dofetilide是禁忌
在这些患者中步骤4。管理TIKOSYN调整剂量,并开始连续心电图监测。
第5步。在2 - 3小时后管理第一剂TIKOSYN。确定高职院校学前教育专业增加了超过15%,如果高职院校学前教育专业相对于基线建立在步骤1或大于500 msec如果高职院校学前教育专业(550毫秒)患者心室传导异常,后续计量应调整如下:
如果起始剂量的基础上
肌酐清除率是:调整剂量
(延长为高职院校学前教育专业):500毫克每日两次250微克每天两次250毫克每日两次125微克每天两次125毫克每日两次125微克一天一次步骤6。在每个后续剂量的TIKOSYN 2 - 3小时后,(住院剂2 - 5)决定了高职院校学前教育专业。没有进一步的滴定TIKOSYN建议基于高职院校学前教育专业。
注意:如果在任何时候在第二次剂量的大于500 msec TIKOSYN是考虑到高职院校学前教育专业(550毫秒)患者心室传导异常,TIKOSYN应该停止。
步骤7。病人要不断进行心电图至少三天,或至少12小时后电或药理转换正常窦性心律,哪个更大。
上述步骤总结如下图:
维护TIKOSYN疗法每三个月应重新评估肾功能和高职院校学前教育专业或医学上有保障。超过500毫秒如果高职院校学前教育专业(550毫秒)患者心室传导异常,TIKOSYN治疗应停药,病人应仔细监控回到基线水平。直到高职院校学前教育专业如果肾功能恶化,调整剂量TIKOSYN开始治疗,所述步骤3。
特殊考虑考虑剂量低于由算法决定上面所示的剂量算法应该用于确定TIKOSYN的个性化的剂量。在临床试验中(见临床研究),最高剂量的500 mcg投标TIKOSYN剂量算法导致修改的效果比低剂量的125或250微克剂量算法修改的。带条de同构的风险,然而,与剂量以及病人特点(参见警告)。医生与患者协商,因此在某些情况下可以选择剂量低于由算法决定。这是非常重要的,如果在任何时候低剂量增加,病人又需要三天。以前的宽容高剂量并不能消除再入院治疗的必要性。
患者的最大推荐剂量计算肌酐清除率大于60毫升/分钟是500微克申请;剂量超过500微克的报价已经带条de同构的发病率增加。
病人错过一次剂量不应下剂量的两倍。下一个剂量应采取在老时间。
复律法如果病人没有在24小时内将正常窦性心律的起始TIKOSYN疗法,应考虑电转换。病人继续TIKOSYN成功电击后应该继续进行心电描记法12小时复律法,或至少3天后发起TIKOSYN疗法,哪个更大。
切换到TIKOSYN从类或其他第三类抗心律失常的治疗TIKOSYN治疗开始之前,先前的抗心律失常的治疗应该撤回在小心监测至少三(3)血浆半衰期。由于不可预知的胺碘酮的药物动力学,TIKOSYN不应启动直到胺碘酮胺碘酮治疗后血浆水平低于0.3微克/毫升或胺碘酮之前已经取消了至少三个月。
之前停止TIKOSYN管理潜在的药物相互作用如果需要停止TIKOSYN允许剂量的其他潜在的药物相互作用,冲刷的至少两天内开始前应遵循其他药物(s)。
登录到你的免费帐户